厚生労働省の専門部会が、人工多能性幹細胞(iPS細胞)を使った二つの再生医療製品について、条件や期限を設けて製造販売を早期承認することを了承しました。近く厚労相が承認し、世界初のiPS細胞製品となる見込みです。1分で読めて役に立つ「サクッとニュース」、今回は「iPS製品の世界初承認へ」について解説します。
Q 今回の承認にはどんな意味があるの?
A 京都大の山中伸弥教授らの研究チームが2006年、世界で初めてマウスの細胞からiPS細胞の作製に成功したことを報告しました。それから20年になりますが、さまざまな臨床研究や治験を経て、実用化に一歩踏み出す形になります。
Q 承認される製品はどんなものなの?
A 一つは、重症心不全を対象にした「リハート」です。大阪大発ベンチャー「クオリプス」(東京都)が開発しました。心臓の表面にiPS細胞からつくった心筋シートを移植し、生理活性物質のサイトカインが分泌されることで心臓に新たな血管が再生します。
Q もう一つは?
A パーキンソン病を対象にした「アムシェプリ」で、住友ファーマ(大阪市)が申請しました。患者の脳にiPS細胞からつくった神経のもとになる細胞を移植します。
Q 二つの製品はどうやって審査されたのかな。
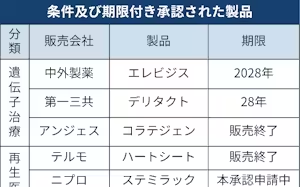
A 実用化に時間のかかる再生医療を早く患者に届けるための「条件・期限付き承認制度」で審査されました。少数の治験症例から有効性が推定された製品を「仮免許」のように早期承認する仕組みです。7年以内にそれぞれ数十例を調べ、有効性や安全性を示して「本承認」を取る必要があります。
鄭重声明:本文の著作権は原作者に帰属します。記事の転載は情報の伝達のみを目的としており、投資の助言を構成するものではありません。もし侵害行為があれば、すぐにご連絡ください。修正または削除いたします。ありがとうございます。